FastKing gDNA Dispelling RT SuperMix
Асаблівасці
■ Хутка: Адзін крок для завяршэння выдалення геному і эфектыўнай зваротнай транскрыпцыі на працягу 18 хвілін, толькі дадаўшы шаблоны.
■ Высокая эфектыўнасць: зваротная транскрыптаза мадыфікавана з гідрафобным матывам, з эфектыўнасцю РТ, якая перавышае 95%.
■ Просты і лёгкі: эксклюзіўная термочувствительная ДНКаза мае хуткі эфект, высокую эфектыўнасць з меншым часам рэакцыі і не ўплывае на кДНК.
Спецыфікацыя
Тып: Ген мадыфікаваная зваротная транскрыптаза, gDNase
Працэдуры: Аднакрокавы (выдаленне геномнай ДНК і RT)
Эфектыўнасць RT: > 95%
Шаблон: 1 нг- 2 мкг
Час працы: ~ 18 мін
Прыкладання: Зваротна транскрыбаваная кДНК можа быць выкарыстана ў звычайнай ПЦР, ПЦР у рэальным часе, пабудове бібліятэкі кДНК, SAGE (серыйны аналіз экспрэсіі генаў), пашырэнні праймера і іншых звычайных эксперыментах.
Усе прадукты можна наладзіць для ODM/OEM. Для падрабязнасцей,калі ласка, націсніце Індывідуальнае абслугоўванне (ODM/OEM)
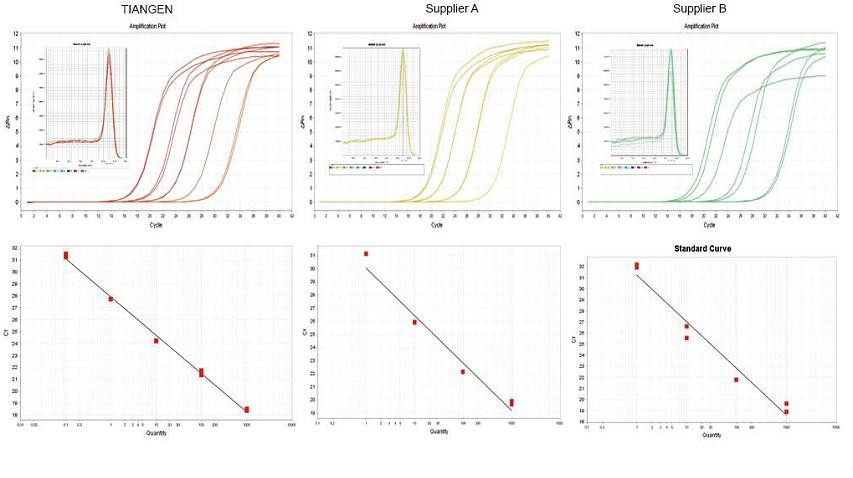 |
Эксперыментальны прыклад 1. кДНК была сінтэзавана з выкарыстаннем аднаэтапных зваротных колькасных рэагентаў гДНК TIANGEN FastKing Dispelling RT SuperMix, адпаведных прадуктаў ад Пастаўшчыка А і Пастаўшчыка В адпаведна. Выявіце ген RN5 мышэй з дапамогай TIANGEN Talent qPCR PreMix (SYBR Green), а таксама прааналізавалі крывую ампліфікацыі, крывую плаўлення і стандартную крыву. Вынікі паказваюць, што TIANGEN FastKing gDNA Dispelling RT SuperMix мае самае высокае колькаснае значэнне Ct пасля зваротнай транскрыпцыі і выдатную ўстойлівасць да стрэсаў, а таксама мае відавочныя перавагі для шаблонаў з высокімі рэшткамі прымешак. |
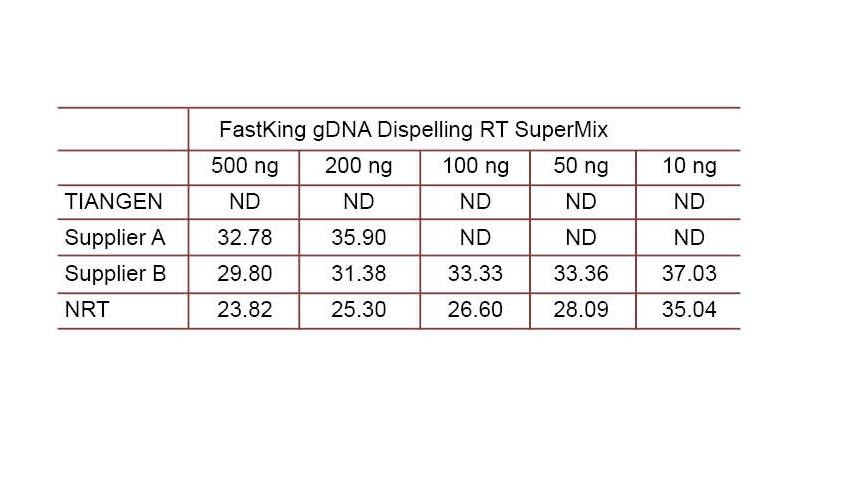 |
Эксперыментальны прыклад 2. кДНК была сінтэзавана з выкарыстаннем аднаэтапных зваротных колькасных рэагентаў ад TDANGEN FastKing гДНК, якая рассейвае RT SuperMix, адпаведныя прадукты ад Пастаўшчыка А і Пастаўшчыка В адпаведна. Выявіце чалавечы ген HsG з дапамогай TIANGEN Talent qPCR PreMix (SYBR Green) і ўручную дадайце розныя канцэнтрацыі геномнай ДНК, каб выявіць здольнасць выдалення гДНК розных рэагентаў. Вынікі Ct паказваюць, што TIANGEN FastKing gDNA Dispelling RT SuperMix мае выдатную здольнасць выдаляць геномную ДНК. Да 500 нг рэшткаў геномнай ДНК можна выдаліць ідэальна, не ўплываючы на вынікі. ND: Не выяўлена. NRT: Выяўленне сумесі без зваротнай транскрыпцыі. |
Разбураецца РНК А-1
—— Ачысціць высакаякасную РНК без забруджванняў. Матэрыял, з якога экстрагуецца РНК, павінен быць максімальна свежым, каб прадухіліць разбурэнне РНК. Перад рэакцыяй РТ прааналізуйце цэласнасць РНК на дэнатураваным гелі. Пасля экстракцыі РНК яе трэба захоўваць у 100% фармамідзе. Калі выкарыстоўваецца інгібітар РНКазы, тэмпература нагрэву павінна быць <45 ° С, а рН павінен быць менш за 8,0, інакш інгібітар вызваліць усю звязаную РНКазу. Акрамя таго, інгібітар РНКазы варта дадаваць у растворы, якія змяшчаюць ≥ 0,8 мМ ДТТ.
А-2 РНК змяшчае інгібітары рэакцый зваротнай транскрыпцыі
—— Інгібітары зваротнай транскрыпцыі ўключаюць SDS, EDTA, гліцэрына, пірафасфат натрыю, спермідзін, фармамід, гуанідзінавую соль і г. д. Змяшайце кантрольную РНК з узорам і параўнайце выхад з кантрольнай РНК, каб праверыць, ці ёсць інгібітар. Прамыйце ападкі РНК 70% (аб./Об.) Этанолам для выдалення інгібітараў.
А-3 Недастатковы адпал праймераў, якія выкарыстоўваюцца для сінтэзу першай ніткі кДНК
—— Вызначце, што тэмпература адпалу падыходзіць для грунтоўкі, якія выкарыстоўваюцца ў эксперыменце. Для выпадковых гексамераў рэкамендуецца падтрымліваць тэмпературу на ўзроўні 25 ° С на працягу 10 хвілін да дасягнення тэмпературы рэакцыі. Для генаў-спецыфічных праймераў (GSP) паспрабуйце іншы GSP або перайдзіце на олиго (dT) або выпадковы гексамер.
А-4 Невялікая колькасць зыходнай РНК
—— Павелічэнне колькасці РНК. Для ўзораў РНК менш за 50 нг, 0,1 мкг да 0,5 мкг ацэтылу BSA можна выкарыстоўваць у сінтэзе кДНК першай ніткі
А-5 Паслядоўнасць мішэні не выяўляецца ў аналізаваных тканінах.
—— Паспрабуйце іншыя тканіны.
Рэакцыя ПЦР А-6 няўдалая
-Для двухступенчатай RT-ПЦР шаблон кДНК на этапе ПЦР не можа перавышаць 1/5 аб'ёму рэакцыі.
A-1 Неспецыфічны адпал грунтоўкі і шаблонаў
—— 3'-канцы праймераў не павінны ўтрымліваць 2-3 dG або dC. Выкарыстоўвайце ген-спецыфічныя праймеры ў сінтэзе першай ніткі замест выпадковых праймераў або олиго (dT). Выкарыстоўвайце больш высокую тэмпературу адпалу ў першыя некалькі цыклаў, а затым больш нізкую тэмпературу адпалу. Для паляпшэння спецыфічнасці рэакцыі выкарыстоўвайце ДНК-палімеразу Taq з гарачым стартам.
А-2 Дрэнная канструкцыя ген-спецыфічных праймераў
—— Выконвайце тыя ж прынцыпы для дызайну ўзмацнення грунтоўкі.
РНК А-3, забруджаная геномнай ДНК
—— Лячэнне РНК з ДНКазай I. ПЦР. Наладзьце кантрольную рэакцыю без зваротнай транскрыпцыі для выяўлення забруджвання ДНК.
А-4 Фарміраванне грунтавага дымера
—— Дызайн праймераў без дадатковых паслядоўнасцей на 3 'канцы.
А-5 Занадта высокі Mg2+ канцэнтрацыя
—— Аптымізаваць Mg2+ канцэнтрацыя для кожнай камбінацыі шаблону і грунтоўкі
А-6 Забруджаны чужароднай ДНК
—— Выкарыстоўвайце аэразольнаўстойлівыя наканечнікі і ферменты UDG.
A-1 Занадта высокае ўтрыманне прадукту першай ніткі
—— Паменшыць колькасць прадукту першай ніткі на звычайнай стадыі рэакцыі ПЦР.
А-2 Занадта вялікая колькасць грунтоўкі ў рэакцыі ПЦР
—— Паменшыць увод грунтоўкі.
A-3 Занадта шмат цыклаў
—— Аптымізаваць умовы рэакцыі ПЦР і паменшыць колькасць цыклаў ПЦР.
A-4 Занадта нізкая тэмпература адпалу
—— Павялічце тэмпературу адпалу, каб прадухіліць неспецыфічнае пачатак і падаўжэнне.
А-5 Неспецыфічная ампліфікацыя фрагментаў алігануклеатыдаў, якія ўзнікаюць у выніку дэградацыі ДНКазы ДНК-вылучаюць высакаякасную РНК, каб прадухіліць заражэнне ДНК.
RT-ПЦР заключаецца ў зваротнай транскрыпцыі РНК у кДНК, а затым у выкарыстанні зваротнай транскрыпванай кДНК у якасці матрыцы для рэакцыі ПЦР для ампліфікацыі фрагмента-мішэні. Выбірайце альбо выпадковыя праймеры, Oligo dT і ген -спецыфічныя праймеры ў адпаведнасці з канкрэтнымі ўмовамі эксперыменту. Усе вышэйпералічаныя праймеры можна выкарыстоўваць для кароткай мРНК эукарыятычных клетак без структуры шпілек.
Выпадковы праймер: падыходзіць для доўгай РНК са структурай шпілек, а таксама для ўсіх відаў РНК, такіх як рРНК, мРНК, тРНК і г.
Oligo dT: Падыходзіць для РНК з хвастом PolyA (пракарыётычная РНК, эўкарыятычная рРНК Oligo dT і тРНК не маюць хвастоў PolyA). Паколькі Oligo dT звязаны з хвастом PolyA, якасць узораў РНК павінна быць высокай, і нават невялікая колькасць дэградацыі значна знізіць колькасць поўнафарматнага сінтэзу кДНК.
Ген-спецыфічны праймер: Камплементарны паслядоўнасці шаблону, падыходзіць для сітуацый, калі мэтавая паслядоўнасць вядомая.
Ёсць два шляхі:
1. Унутраны метад адліку: У тэорыі кДНК - гэта фрагменты ДНК рознай даўжыні, таму вынікам электрафарэзу з'яўляецца мазок. Калі ўтрыманне РНК нізкае, у электрафарэзе не будзе паказаны ні адзін прадукт, але гэта не значыць, што ніякі прадукт не будзе ампліфікаваны з дапамогай ПЦР. Увогуле, для выяўлення кДНК можна выкарыстоўваць унутраны эталон. Калі ўнутраная спасылка дае вынікі, якасць кДНК можа быць у асноўным гарантавана (у некаторых выпадках, калі фрагмент гена -мішэні занадта доўгі, могуць быць выключэнні).
2. Калі ёсць вядомы ген, узмоцнены гэтым шаблонам, гэта можна праверыць з дапамогай праймераў гэтага гена. Узмацненне ўнутранай спасылкі не абавязкова азначае, што няма праблем з кДНК. Паколькі ўнутраная спасылка мае вялікую колькасць кДНК, яе лёгка ўзмацніць. Калі кДНК часткова дэградуецца па розных прычынах, з пункту гледжання верагоднасці, вынікі ПЦР генаў -мішэняў з нізкім утрыманнем моцна паўплываюць. У той час як унутраныя спасылкі ўсё яшчэ багатыя, на ўзмацненне гэта, верагодна, не паўплывае.
Часткова дэградуе РНК. Выявіць цэласнасць і ачысціць РНК
Змест РНК розных відаў можа быць розным, але ў цэлым вынятая агульная РНК павінна ўтрымліваць дзве выразныя паласы 28S і 18S у гель -электрафарэзе, а яркасць першай паласы павінна быць удвая вышэйшай, чым у другой. Паласа 5S паказвае, што РНК была дэградаваная, а яе яркасць прапарцыйная ступені дэградацыі. Паспяховае ўзмацненне ўнутранай спасылкі не азначае, што няма праблем з РНК, таму што ўнутраная спасылка ў вялікай колькасці, РНК можна ўзмацняць, пакуль дэградацыя не з'яўляецца сур'ёзнай. OD260/АД280суадносіны чыстай РНК, вымеранае з дапамогай спектрофотометра, павінна быць ад 1,9 да 2,1. Невялікая колькасць прымешак бялку ў РНК знізіць суадносіны. Пакуль значэнне не занадта нізкае, на RT гэта не паўплывае. Самае важнае для РТ - гэта цэласнасць РНК.
Пашырэнне ўнутранага эталоннага гена можа паказваць толькі на тое, што RT атрымалася, але гэта не абавязкова звязана з якасцю ланцуга кДНК. Паколькі ўнутраныя апорныя фрагменты, як правіла, маюць невялікі памер і высокую экспрэсію, ім лягчэй дасягнуць поспеху ў зваротнай транскрыпцыі. Аднак памер і экспрэсія гена -мішэні вар'іруюцца ад гена да гена. Якасць кДНК нельга ацэньваць толькі па ўнутраных спасылках, асабліва для фрагментаў -мішэняў даўжынёй больш за 2 кб.
Некаторыя ўзоры маюць складаныя другасныя структуры, або маюць багатае ўтрыманне ГХ, або каштоўныя з невялікай колькасцю. У гэтых выпадках варта выбраць адпаведную зваротную транскрыптазу ў адпаведнасці з памерам фрагмента -мішэні і ўзору. Для шаблонаў РНК з высокім утрыманнем ГХ і складанай другаснай структурай цяжка адкрыць другасную структуру пры нізкай тэмпературы або з дапамогай звычайнай зваротнай транскрыптазы. Для гэтых шаблонаў можна выбраць зваротную транскрыптазу Quant, паколькі яе прадукцыйнасць зваротнай транскрыпцыі відавочна лепшая, чым у зваротнай транскрыптазы серыі M-MLV, якая можа эфектыўна адмяніць транскрыпцыю розных шаблонаў РНК і максімальна перапісаць РНК у першую ланцужок кДНК. Пры выкарыстанні агульнага набору зваротнай транскрыптазы сістэма 20 мкл можа эфектыўна адмяніць толькі 1 мкг агульнай РНК. Калі ласка, звярніце ўвагу на максімальную ёмістасць RT камплекта. Калі шаблон дададзены ў лішку, зваротная транскрыпцыя будзе спрыяць РНК з вялікай колькасцю. Таму лепш не перавышаць максімальную магутнасць сістэмы.
A-1 Вызначце, ці моцна дэградуе РНК, і ці паспяхова праведзена РТ
Увогуле, прычына збою ўнутранага эталоннага ўзмацнення часта выклікана сур'ёзнай дэградацыяй РНК. Іншая магчымая прычына - збой зваротнай транскрыпцыі. Унутраная спасылка не можа быць выкарыстана ў якасці стандарту для ацэнкі якасці кДНК з адной ніткай, але яна можа быць выкарыстана ў якасці стандарту, каб вызначыць, ці паспяховая зваротная транскрыпцыя, калі няма праблем з якасцю РНК. Самае галоўнае ў працэсе зваротнай транскрыпцыі - падтрымліваць пастаянную тэмпературу і пастаянную сістэму рэакцыі з мэтай павышэння эфектыўнасці рэакцыі.
А-2 Вызначце, ці надзейныя праймеры для ампліфікацыі генаў унутраных рэферэнцый і ці ёсць праблемы з рэагентамі, якія выкарыстоўваюцца ў ПЦР.
Для адноснага колькаснага вызначэння РНК неабходна колькасна ацаніць перад зваротнай транскрыпцыяй, што таксама патрабуецца ў многіх наборах зваротнай транскрыпцыі, напрыклад, колькасна вызначыць ўваходную РНК як 1 мкг. Паколькі кДНК з зваротнай транскрыпцыяй з'яўляецца змешаным растворам, уключаючы РНК, оліго dT, фермент, dNTP і нават невялікую колькасць рэшткаў ДНК, адхіленне будзе выклікана, таму немагчыма дакладна ацаніць кДНК. Такім чынам, неабходная колькасная ацэнка РНК. Улічваючы, што эфектыўнасць зваротнай транскрыпцыі аднолькавая сярод розных узораў, колькасць атрыманай кДНК павінна быць аднолькавым, а колькасны аналіз можа паказаць параўнанне ўзроўняў экспрэсіі розных генаў у аднолькавай колькасці агульнай РНК. Пры правядзенні адноснай флуарэсцэнтнай колькаснай ПЦР пасля зваротнай транскрыпцыі можа не спатрэбіцца колькасная кДНК, паколькі ўнутраны эталонны ген можа выступаць у якасці эталоннага.
У асноўным гэта звязана з генамі, і зваротная транскрыпцыя доўгіх фрагментаў немагчымая для большасці генаў. Па -першае, эфектыўнасць зваротнай транскрыпцыі значна ніжэйшая за эфектыўнасць ПЦР. Па -другое, багатая ГК вобласць і другасная структура многіх генаў абмяжоўваюць як зваротную транскрыпцыю, так і ПЦР. Нарэшце, дакладнасць і эфектыўнасць ампліфікацыі ПЦР цяжка гарантаваць адначасова. У працэсе зваротнай транскрыпцыі ніхто не можа гарантаваць атрымаць доўгі фрагмент для генаў з нізкай капіяваннем, асабліва з выкарыстаннем oligo dT. Што тычыцца 5 'UTR з большай колькасцю ГХ, то гэта яшчэ больш складана. Такім чынам, па -ранейшаму з'яўляецца разумным метадам адмяніць транскрыпцыю з дапамогай выпадковых праймераў, знайсці месцы натуральнага расшчаплення ў фрагменце -мішэні, ампліфікаваць па сегментах, а затым выканаць абмежаванне стрававання і перавязкі. Увогуле, непасрэдна ампліфікаваць фрагменты памерам больш за 2 кб цяжка, але атрымаць іх не заўсёды магчыма: 1. Па -першае, гарантуйце цэласнасць РНК/мРНК, і пераважней экстракцыя ТРІЗОЛу. 2. М-MLV RT-PCR камплект можа быць непасрэдна выкарыстаны. Павялічце час адпалу і належным чынам павялічвайце колькасць цыклаў у працэсе ампліфікацыі. Акрамя таго, можна ўжыць укладзеную ПЦР або спачатку правесці адну або дзве рэакцыі з адпаведным падаўжэннем часу дэнатурацыі і падаўжэння да нармальнай ПЦР -ампліфікацыі, што можа дапамагчы пашырыць фрагменты. Звярніце ўвагу на дакладнасць палімеразы. 3. Доўгі Taq можна выкарыстоўваць у ПЦР для атрымання ідэальных вынікаў. 4. Для прымянення экспрэсіі бялку варта ўжываць палімеразу высокай дакладнасці.
TIANGEN прапануе два віды зваротнай транскрыптазы: Quant/King RTase і TIANScript M-MLV. Асноўнае адрозненне паміж імі заключаецца ў колькасці шаблонаў. Quant-гэта ўнікальная зваротная транскрыптаза, якая адрозніваецца ад звычайна выкарыстоўванай M-MLV, атрыманай з віруса лейкозу мышэй Moloney. Quant-гэта новая высокаэфектыўная зваротная транскрыптаза, рэкамбінантна выказаная інжынернай кішачнай палачкай. Quant падыходзіць для ампліфікацыі 50 нг-2 мкг РНК з высокай зваротнай транскрыпцыйнай актыўнасцю і высокім выхадам. У параўнанні са звычайнымі MMLV або AMV, самая галоўная характарыстыка Quant у тым, што ён мае вельмі моцнае сваяцтва з шаблонамі РНК і можа адмяняць складаныя шаблоны расшыфроўкі без высокай тэмпературы дэнатурацыі. Для шаблонаў з большым утрыманнем ГХ, зваротная эфектыўнасць вышэй. Аднак гэтая зваротная транскрыптаза валодае актыўнасцю РНКазы Н, якая можа ўплываць на даўжыню прадукту кДНК (падыходзіць для шаблонаў памерам <4,5 кб). Для звычайнай зваротнай транскрыпцыі рэкамендуецца зваротная транскрыптаза TIANScript MMLV. Гэтая RTase - гэта мадыфікаваны фермент з вельмі слабой актыўнасцю РНКазы Н, які падыходзіць для працяглага (> 5 кб) сінтэзу кДНК.
Аднакрокавая зваротная транскрыпцыя і ПЦР-ампліфікацыя завяршаюцца ў адной трубцы без адкрыцця вечка трубкі паміж сінтэзам кДНК і ампліфікацыяй, што карысна для памяншэння забруджвання. Паколькі ўсе атрыманыя ўзоры кДНК выкарыстоўваюцца для ампліфікацыі, адчувальнасць вышэй, мінімум 0,01 пг агульнай РНК. Для паспяховага аднаэтапнага RTPCR для пачатку сінтэзу кДНК звычайна выкарыстоўваюць ген-спецыфічныя праймеры. Двухэтапны метад, а менавіта зваротная транскрыпцыя і ПЦР-ампліфікацыя, ажыццяўляецца ў два этапы. Спачатку праводзяць зваротную транскрыпцыю з матрыцы РНК для атрымання кДНК, а атрыманую кДНК падвяргаюць адной або некалькім розным рэакцыям ПЦР. Двухэтапны метад можа выкарыстоўваць олиго (dT) або выпадковыя праймеры для накіравання сінтэзу першай ланцуга кДНК і можа адмяніць транскрыпцыю ўсёй інфармацыі мРНК з пэўнага ўзору.
Катэгорыі прадуктаў
Чаму выбіраюць нас
З моманту свайго заснавання наша фабрыка распрацоўвае прадукты першага сусветнага класа з захаваннем прынцыпу
якасць у першую чаргу. Наша прадукцыя заваявала выдатную рэпутацыю ў прамысловасці і каштоўную давер сярод новых і старых кліентаў.